Human eggs remain healthy for decades by putting ‘batteries on standby mode’
Human eggs remain healthy for decades by putting ‘batteries on standby mode’
Human eggs remain healthy for decades by putting ‘batteries on standby mode’
Study in Nature explains how cells remain dormant in ovaries without losing their reproductive capacity.
Immature human egg cells skip a fundamental metabolic reaction thought to be essential for generating energy, according to the findings of a study by researchers at the Centre for Genomic Regulation (CRG) published today in the journal Nature.
By altering their metabolic activity, the cells avoid creating reactive oxygen species, harmful molecules that can accumulate, damage DNA and cause cell death. The findings explain how human egg cells remain dormant in ovaries for up to 50 years without losing their reproductive capacity.
“Humans are born with all the supply of egg cells they have in life. As humans are also the longest-lived terrestrial mammal, egg cells have to maintain pristine conditions while avoiding decades of wear-and-tear. We show this problem is solved by skipping a fundamental metabolic reaction that is also the main source of damage for the cell. As a long-term maintenance strategy, its like putting batteries on standby mode. This represents a brand new paradigm never before seen in animal cells,” says Dr. Aida Rodriguez, postdoctoral researcher at the CRG and first author of the study.
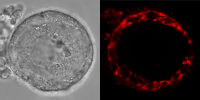
Human eggs are first formed in the ovaries during foetal development, undergoing different stages of maturation. During the early stages of this process, immature egg cells known as oocytes are put into cellular arrest, remaining dormant for up to 50 years in the ovaries. Like all other eukaryotic cells, oocytes have mitochondria – the batteries of the cell – which they use to generate energy for their needs during this period of dormancy.
Using a combination of live imaging, proteomic and biochemistry techniques, the authors of the study found that mitochondria in both human and Xenopus oocytes use alternative metabolic pathways to generate energy never before seen in other animal cell types.
A complex protein and enzyme known as complex I is the usual ‘gatekeeper’ that initiates the reactions required to generate energy in mitochondria. This protein is fundamental, working in the cells that constitute living organisms ranging from yeast to blue whales. However, the researchers found that complex I is virtually absent in oocytes. The only other type of cell known to survive with depleted complex I levels are all the cells that make up the parasitic plant mistletoe.
According to the authors of the study, the research explains why some women with mitochondrial conditions linked to complex I, such as Leber’s Hereditary Optic Neuropathy, do not experience reduced fertility compared to women with conditions affecting other mitochondrial respiratory complexes.
The findings could also lead to new strategies that help preserve the ovarian reserves of patients undergoing cancer treatment.
“Complex I inhibitors have previously been proposed as a cancer treatment. If these inhibitors show promise in future studies, they could potentially target cancerous cells while sparing oocytes,” explains Dr. Elvan Böke, senior author of the study and Group Leader in the Cell & Developmental Biology programme at the CRG.
Oocytes are vastly different to other types of cells because they have to balance longevity with function. The researchers plan to continue this line of research and uncover the energy source oocytes use during their long dormancy in the absence of complex I, with one of the aims being to understand the effect of nutrition on female fertility.
“One in four cases of female infertility are unexplained – pointing to a huge gap of knowledge in our understanding of female reproduction. Our ambition is to discover the strategies (such as the lack of complex I ) oocytes employ to stay healthy for many years in order to find out why these strategies eventually fail with advanced age” concludes Dr. Böke.
The study received funding from the Spanish Ministry of Science and Innovation, and the European Research Council and support from the CRG Core Facilities for Advanced Light Microscopy, Histology, and Proteomics.
Reference:
Rodríguez-Nuevo A., Torres-Sanchez A., Duran J.M., De Guirior C., Martínez-Zamora M.A., Böke E.
Oocytes maintain ROS-free mitochondrial metabolism by suppressing complex I.
Nature, July 20, 2022. https://www.nature.com/articles/s41586-022-04979-5 | DOI: https://doi.org/10.1038/s41586-022-04979-5
EN ESPAÑOL
Los ovocitos humanos ponen ‘el motor en punto muerto’ para mantenerse sanos durante décadas
El estudio explica cómo las células permanecen en estado latente en los ovarios sin perder su capacidad reproductiva
Los óvulos humanos inmaduros se saltan una reacción metabólica fundamental para generar energía, según los hallazgos de un estudio llevado a cabo por un equipo científico del Centro de Regulación Genómica (CRG), publicado hoy en la revista Nature.
Al alterar su actividad metabólica, las células evitan la creación de especies reactivas de oxígeno, moléculas dañinas que pueden acumularse, dañar el ADN y causar la muerte celular. Los hallazgos explican cómo los ovocitos humanos permanecen en estado latente en los ovarios hasta 50 años sin perder su capacidad reproductiva.
“Los humanos nacen con todo el suministro de óvulos que tienen en vida. Como los humanos también son los mamíferos terrestres más longevos, los óvulos deben mantenerse en condiciones impecables y evitar décadas de desgaste. Mostramos que este problema se resuelve omitiendo una reacción metabólica fundamental que también es la principal fuente de daños para la célula. Como estrategia de mantenimiento a largo plazo, es como poner el motor en punto muerto. Esto representa un nuevo paradigma nunca antes visto en células animales”, afirma la Dra. Aida Rodríguez, investigadora postdoctoral en el CRG y primera autora del estudio.
Los óvulos humanos se forman por primera vez en los ovarios durante el desarrollo fetal, pasando por diferentes etapas de maduración. Durante las primeras etapas, los óvulos inmaduros – conocidos como ovocitos – permanecen en un estado de arresto celular, y perduran inactivos hasta 50 años en los ovarios. Como todas las células eucariotas, los ovocitos contienen mitocondrias, las baterías o el motor de la célula, que utilizan para generar energía para sus necesidades durante este período de latencia.
Usando una combinación de imágenes en vivo, técnicas proteómicas y bioquímicas, las autoras del estudio encontraron que las mitocondrias en los ovocitos humanos y de ranas Xenopus usan vías metabólicas alternativas para generar energía nunca antes vistas en otros tipos de células animales.
Un complejo enzimático conocido como complejo I es el habitual punto de entrada que inicia las reacciones necesarias para generar energía en las mitocondrias. Esta enzima es fundamental, y trabaja en las células que constituyen los organismos vivos que van desde la levadura hasta las ballenas azules. Sin embargo, el equipo científico descubrió que el complejo I está prácticamente ausente en los ovocitos. El único otro caso que se conoce y que sobrevive con niveles reducidos de complejo I son todas las células que componen el muérdago, una planta parásita.
Según las autoras del estudio, la investigación explica por qué algunas mujeres con afecciones mitocondriales vinculadas al complejo I, como la neuropatía óptica hereditaria de Leber, no experimentan una fertilidad reducida en comparación con mujeres con afecciones que afectan en otros complejos respiratorios mitocondriales.
Los hallazgos también podrían conducir a nuevas estrategias que ayuden a preservar las reservas ováricas de las pacientes que se someten a un tratamiento contra el cáncer.
“Los inhibidores del complejo I se han propuesto previamente como tratamiento contra el cáncer. Si estos inhibidores se muestran prometedores en estudios futuros, podrían dirigirse potencialmente a las células cancerosas sin afectar a los ovocitos”, explica la Dra. Elvan Böke, autora principal del estudio y jefa de grupo en el programa de Biología Celular y del Desarrollo en el CRG.
Los ovocitos son muy diferentes a otros tipos de células porque tienen que equilibrar la longevidad con la función. Las investigadoras planean continuar con esta línea de investigación y descubrir la fuente de energía que utilizan los ovocitos durante su larga etapa de latencia en ausencia del complejo I, siendo uno de los objetivos comprender el efecto de la nutrición en la fertilidad femenina.
“Uno de cada cuatro casos de infertilidad femenina no tiene explicación, lo que apunta a una gran brecha de conocimiento en nuestra comprensión de la reproducción femenina. Nuestra ambición es descubrir las estrategias (como la falta del complejo I) que emplean los ovocitos para mantenerse saludables durante muchos años para descubrir por qué estas estrategias finalmente fallan con la edad avanzada”, concluya la Dra. Böke.
El estudio recibió el apoyo del Ministerio de Ciencia e Innovación y el Consejo Europeo de Investigación, y el apoyo de las unidades de Microscopía Óptica Avanzada, de Histología y de Proteómica del CRG.
Referencia
Rodríguez-Nuevo A., Torres-Sanchez A., Duran J.M., De Guirior C., Martínez-Zamora M.A., Böke E.
Oocytes maintain ROS-free mitochondrial metabolism by suppressing complex I.
Nature, July 20, 2022. https://www.nature.com/articles/s41586-022-04979-5 | DOI: https://doi.org/10.1038/s41586-022-04979-5
EN CATALÀ
Els ovòcits humans posen ‘el motor en punt mort’ per mantenir-se sans durant dècades
L’estudi explica com les cèl·lules romanen es estat latent als ovaris sense perdre la seva capacitat reproductiva
Els òvuls humans immadurs se salten una reacció metabòlica fonamental per a generar energia, segons les troballes d’un estudi dut a terme per un equip científic del Centre de Regulació Genòmica (CRG), publicat avui a la revista Nature.
En alterar la seva activitat metabòlica, les cèl·lules eviten la creació d’espècies reactives d’oxigen, molècules nocives que poden acumular-se, danyar l’ADN i causar la mort cel·lular. Les troballes expliquen com els ovòcits humans es mantenen es estat latent als ovaris fins a 50 anys sense perdre la seva capacitat reproductiva.
“Els humans neixen amb tot el subministrament d’òvuls que tenen en vida. Com els humans també són els mamífers terrestres més longeus, els òvuls han de mantenir-se en condicions impecables i evitar dècades de desgast. Mostrem que aquest problema es resol ometent una reacció metabòlica fonamental que també és la principal font de danys per a la cèl·lula. Com a estratègia de manteniment a llarg termini, és com posar el motor en punt mort. Això representa un nou paradigma mai vist abans en cèl·lules animals”, afirma la Dra. Aida Rodríguez, investigadora postdoctoral al CRG i primera autora de l’estudi.
Els òvuls humans es formen per primer cop als ovaris durant el desenvolupament fetal, passant per diferents etapes de maduració. Durant les primeres etapes, els òvuls immadurs – anomenats ovòcits – romanen en un estat d’arrest cel·lular, i perduren inactius fins a 50 anys als ovaris. Com totes les cèl·lules eucariotes, els ovòcits contenen mitocòndries, les bateries o el motor de la cèl·lula, que utilitzen per a generar energia per a les seves necessitats durant aquest període de latència.
Emprant una combinació d’imatges en viu, tècniques proteòmiques i bioquímiques, les autores de l’estudi trobaren que les mitocòndries als ovòcits humans i de granotes Xenopus empren vies metabòliques alternatives per a generar energia mai vistes abans en d’altres tipus de cèl·lules animals.
Un complex enzimàtic conegut amb el nom de complex I és l’habitual punt d’entrada que inicia les reaccions necessàries per a generar energia a les mitocòndries. Aquest enzim és fonamental, i treballa en les cèl·lules que constitueixen els organismes vius que van des del llevat fins a les balenes blaves. Tanmateix, l’equip científic descobrí que el complex I està pràcticament absent als ovòcits. L’únic altre cas que es coneix i que sobreviu amb nivells reduïts de complex I són totes les cèl·lules que composen el vesc, una planta paràsita.
Segons les autores de l’estudi, la recerca explica per què algunes dones amb afeccions mitocondrials vinculades al complex I, com la neuropatia òptica hereditària de Leber, no experimenten una fertilitat reduïda en comparació amb dones amb afeccions que afecten en d’altres complexos respiratoris mitocondrials.
Les troballes també podrien conduir a noves estratègies que ajudin a preservar les reserves ovàriques de les pacients que se sotmeten a un tractament contra el càncer.
“Els inhibidors del complex I s’han proposat prèviament com a tractament contra el càncer. Si aquests inhibidors es mostren prometedors en estudis futurs, podrien dirigir-se potencialment a les cèl·lules canceroses sense afectar els ovòcits”, explica la Dra. Elvan Böke, autora principal de l’estudi i cap de grup al programa de Biologia Cel·lular i del Desenvolupament al CRG.
Els ovòcits són molt diferents a d’altres tipus de cèl·lules perquè han d’equilibrar la longevitat amb la funció. Les investigadores planegen continuar amb aquesta línia de recerca i descobrir la font d’energia que utilitzen els ovòcits durant la seva llarga etapa de latència en absència del complex I, essent un dels objectius comprendre l’efecte de la nutrició en la fertilitat femenina.
“Un de cada quatre casos d’infertilitat femenina no té explicació, fet que apunta a una gran bretxa de coneixement en la nostra comprensió de la reproducció femenina. La nostra ambició és descobrir estratègies (com la manca del complex I) que empren els ovòcits per a mantenir-se saludables durant molts anys per descobrir per què aquestes estratègies finalment fallen amb l’edat avançada”, conclou la Dra. Böke.
L'estudi rebé el suport del Ministerio de Ciencia e Innovación i del Consell de Recerca Europeu, i també el suport de les unitats de Microscòpia Òptica Avançada, d’Histologia i de Proteòmica del CRG.
Referència
Rodríguez-Nuevo A., Torres-Sanchez A., Duran J.M., De Guirior C., Martínez-Zamora M.A., Böke E.
Oocytes maintain ROS-free mitochondrial metabolism by suppressing complex I.
Nature, July 20, 2022. https://www.nature.com/articles/s41586-022-04979-5 | DOI: https://doi.org/10.1038/s41586-022-04979-5