NEWS
NEWS
Fully functional pancreatic beta cells created from stem cells for the first time
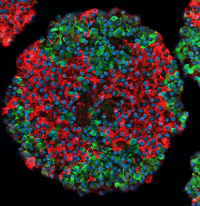
Stem cell derived islet, insulin-producing beta cells marked in red, glucagon-producing alpha cells marked in green. Credit: Väinö Lithovius/University of Helsinki
EN CASTELLANO/EN CATALÀ
- A new study in Nature Biotechnology demonstrates, for the first time, that stem cells can form cells that closely mimic the structure and function of normal pancreatic islets
- The researchers transplanted the stem cell–derived beta cells into mice and showed they can effectively manage glucose metabolism, “even better than the pancreatic islets isolated from organ donors”
- Diego Balboa, first author of the paper and researcher at the Centre for Genomic Regulation (CRG) says treating diabetes patients with these type of cells is “no longer in the realms of science fiction”
Insulin is a vital hormone produced by pancreatic beta cells. Type 1 diabetes is caused by the destruction of these cells, which results in patients having to replace the lost insulin with multiple daily injections.
Insulin secretion can be restored in diabetic patients by transplanting beta cells isolated from the pancreas of a brain dead organ donor. However, this treatment has not been widely introduced, since cells from at least two donors are needed to cure one diabetic.
For a long time, attempts have been made to produce functional beta cells from stem cells, which could make this treatment increasingly common. However, the beta cells produced from stem cells have so far been immature, with poorly regulated insulin secretion. This may be a partial explanation for why no breakthroughs have been achieved in the clinical trials based on immature cells ongoing in the United States.
A research group headed by Professor Timo Otonkoski at the University of Helsinki, and carried out in collaboration with EMBO Postdoctoral Fellow Diego Balboa at the CRG, previously a PhD student in Professor Otonkoski’s lab, has carried out pioneering efforts to optimise the functionality of pancreatic cells produced from stem cells.
In a study published today in Nature Biotechnology, the group has demonstrated, for the first time, that stem cells can form cells that closely mimic normal pancreatic islets, in terms of both structure and function.
“In our study, insulin secretion was regulated as usual in cells, and the cells responded to changes in the glucose level even better than the pancreatic islets isolated from organ donors that were used as controls,” says Väinö Lithovius, a member of the research group at the University of Helsinki.
“Our work makes important advances in transfoming stem cells into spare pieces that could be used to replace the failing cells in the human pancreas that cause diabetes. Though there is more work to be done, these findings bring us one step closer to treating diabetes patients with stem-cell derived islet cells, something that is no longer in the realms of science-fiction,” says Diego Balboa.
The researchers demonstrated the function of stem cell–derived beta cells in both cell cultures and mice studies. In the latter, the researchers demonstrated that stem cell–derived beta cells transplanted into mice started effectively managing the glucose metabolism of the mice.
“Blood glucose levels are higher in mice than in humans, roughly 8–10 millimolar. After the cell transplantation, the level decreased to that seen in humans, roughly 4–5 millimolar. It remained at this level, proving that the stem cell–derived transplant was capable of regulating blood glucose levels in mice,” says University of Helsinki researcher Jonna Saarimäki-Vire, who was responsible for the cell transplantation.
The survey of beta cell function now published is the most comprehensive in the field: in addition to insulin secretion, the researchers investigated the functionality of systems that regulate insulin secretion, including metabolism and ion channels, also connecting the findings to gene expression occurring during development.
According to Diego Balboa, the stem cell-derived islets will also be useful to study the disease mechanisms behind diabetes. “We can generate millions of these cells in vitro in the lab and ask questions about what genes and cell machinery make the cells fail, helping us unravel the precise molecular causes of diabetes. We could also use the cells to explore the effects of potential new drugs to treat diabetes.”
“Our study will help further improve the production of stem cell islets, which will make it easier to utilise them in disease modelling and cell therapies,” concludes Timo Otonkoski.
EN CASTELLANO
Un equipo científico crea por primera vez células beta pancreáticas funcionales a partir de células madre
- Un estudio en Nature Biotechnology demuestra, por primera vez, que las células madre pueden formar células que imitan de cerca la estructura y función de los islotes pancreáticos normales
- El equipo científico trasplantó las células beta derivadas de células madre en ratones y demostraron que pueden controlar eficazmente el metabolismo de la glucosa, “incluso mejor que los islotes pancreáticos aislados de donantes de órganos”
- Diego Balboa, primer autor del estudio e investigador del Centro de Regulación Genómica (CRG) afirma que tratar a los pacientes diabéticos con este tipo de células “ya no pertenece al ámbito de la ciencia ficción”
La insulina es una hormona vital producida por las células beta del páncreas. La diabetes tipo 1 es causada por la destrucción de estas células, lo que hace que los pacientes tengan que inyectarse insulina multiples veces al día para controlar sus niveles de azúcar en sangre.
Las personas con diabetes pueden recuperar la capacidad de producir insulina mediante el trasplante de células beta aisladas del páncreas de donantes de órganos. Sin embargo, este tratamiento es complejo y poco habitual ya que se necesitan al menos dos donantes para tratar a una persona.
Durante mucho tiempo se ha intentado producir células beta funcionales a partir de células madre para usarlas en los trasplantes, lo que poco a poco está haciendo posible que este tratamiento se convierta en realidad. Sin embargo, las células beta producidas a partir de células madre hasta ahora han sido inmaduras, ya que no regulaban bien la secreción de insulina. Esto podría explicar por qué algunos de los ensayos clínicos de estos tratamientos con células inmaduras que se han llevado a cabo en los Estados Unidos no hayan logrado grandes avances.
Ahora un equipo de investigación encabezado por el profesor Timo Otonkoski en la Universidad de Helsinki, y llevado a cabo en colaboración con el investigador posdoctoral Diego Balboa en el CRG, anteriormente estudiante de doctorado en el laboratorio del profesor Otonkoski, ha llevado a cabo esfuerzos pioneros para optimizar la funcionalidad de las células pancreáticas producidas a partir de células madre.
En un extenso artículo publicado hoy en Nature Biotechnology el grupo ha demostrado, por primera vez, que las células madre pueden formar células que se parecen mucho a los islotes pancreáticos normales, tanto en términos de estructura como de función.
“Nuestro estudio muestra que la secreción de insulina se regula de manera adecuada en las células, y que las células responden a los cambios en el nivel de glucosa incluso mejor que los islotes pancreáticos aislados de donantes de órganos que se usaron como controles”, afirma Väinö Lithovius, miembro del grupo de investigación de la Universidad de Helsinki.
“Nuestro trabajo es un avance importante para transformar las células madre y convertirlas en piezas de repuesto para reemplazar las células beta del páncreas destruidas o estropeadas, que son las causantes de la diabetes. Aunque queda trabajo por hacer, estos hallazgos nos acercan un paso más al tratamiento de personas con diabetes con células beta derivadas de células madre, algo que ya no pertenece al ámbito de la ciencia ficción”, afirma Diego Balboa.
El equipo científico demostró la función de las células beta derivadas de células madre tanto en cultivos celulares como en estudios con ratones. En ratones, los investigadores demostraron que las células beta derivadas de células madre trasplantadas comenzaron a controlar de manera efectiva el metabolismo de la glucosa.
“Los niveles de glucosa en sangre son más altos en ratones que en humanos, aproximadamente entre 8 y 10 milimolar. Después del trasplante de células, el nivel disminuyó al que se había observado en humanos, aproximadamente de 4 a 5 milimolar. Se mantuvo en este nivel, lo que demuestra que el trasplante derivado de células madre era capaz de regular a largo plazo los niveles de glucosa en sangre en ratones”, dice la investigadora de la Universidad de Helsinki Jonna Saarimäki-Vire, responsable del trasplante de células.
El estudio de la función de las células beta publicado hoy es el más completo en el campo hasta la fecha. Además de la secreción de insulina, el equipo científico investigó la funcionalidad de los sistemas que regulan la secreción de insulina, incluidos el metabolismo y los canales iónicos, y también conectaron los hallazgos con la expresión génica en las células individuales.
Según Diego Balboa, los islotes derivados de células madre también son útiles para estudiar los mecanismos de la patología que subyace la diabetes, trabajo que sigue desarrollando en el CRG: “Podemos generar millones de estas células en el laboratorio y hacer preguntas sobre qué defectos en los genes y la maquinaria celular hacen que las células fallen, lo que nos ayuda a desentrañar las causas moleculares precisas de la diabetes y a identificar nuevas dianas terapéuticas. También usamos las células para explorar los efectos de nuevos medicamentos para tratar la diabetes”.
“Nuestro estudio ayudará a mejorar aún más la producción de islotes de células madre, lo que facilitará su uso en modelos de enfermedades y terapias celulares”, concluye Timo Otonkoski.