NOTÍCIES
NOTÍCIES
Pancreatic beta-cell boost in mice paves way for future diabetes treatments
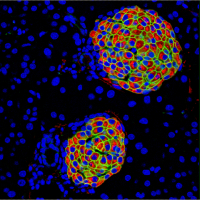
A cross-section of islets of Langerhans, a cluster of cells within the pancreas that are responsible for the production and release of hormones that regulate glucose levels. Insulin in beta cells is stained red, Glut 2 in endocrine cells is stained in green and cell nuclei are stained in blue. Credit: Miguel Angel Maestro/CRG
A research team has uncovered the role of a gene that is critical to boosting the number of insulin-producing cells during the early development of the pancreas. The findings could bolster diabetes research efforts and eventually lead to new replacement therapies for the disease. The findings are published in the journal Genes and Development.
Researchers at the Centre for Genomic Regulation (CRG), the Bellvitge Biomedical Research Institute (IDIBELL) and the University of Barcelona studied the RE1 Silencing Transcription Factor gene, also known as REST, in mouse and zebrafish models as well as in human pancreatic organoids. Researchers have previously suspected a role for this gene in pancreas development, though studies so far have been inconclusive.
They found that REST is expressed in embryonic pancreatic cells which are yet to differentiate, also known as progenitor cells, as well as in adult cells which form the pancreatic duct. The researchers did not detect REST activity in adult beta-cells that produce insulin.
Experiments with mouse models revealed that knocking the REST gene out at the early embryonic stage, before the pancreas is formed, resulted in doubling the number of insulin-producing cells. The cells were maintained into adulthood, with all mice showing normal weight. Further experiments using zebrafish models found similar boosts to beta-cell formation.
Inactivating REST was not able to boost beta cell formation after the pancreas has already formed. Mice with inactivated rest soon after birth exhibited a short-lived boost to endocrine cell formation, but this was not sustained through adulthood. Inactivating REST in human pancreatic organoids did not lead to beta-cell formation, though researchers did detect increased activity of endocrine genes.
“Though important for the development of the pancreas, we have shown that REST is not the sole guardian of endocrine differentiation. However, if one day we come up with a future cocktail of drugs to boost insulin-producing cells in the pancreas, I suspect that REST inhibitors would be part of the recipe. We are now testing whether REST inhibitors can be used to artificially boost the formation of beta cells in a dish,” says Jorge Ferrer, senior author of the study and Group Leader of the Regulatory Genomics and Diabetes at the CRG.
New therapies and treatments that can boost or replace the number of insulin-producing beta cells in the pancreas would transform the treatment of diabetes, which affects over 400 million people worldwide. For people with type-1 diabetes, the only alternative treatment to daily insulin shots are transplantations, requiring potential side effects through taking immunosuppressant medication and hampered by a shortage of organ donors. Being able to boost existing numbers directly in the pancreas would circumvent many of these hurdles.
“REST joins a very short list of dominant suppressors of endocrine differentiation during pancreas development,” says Meritxell Rovira, co-author of the study and researcher with joint affiliation with IDIBELL and the University of Barcelona. “REST modulators will most likely play an important role for future manipulations to promote endocrinogenesis in experimental model systems or replacement therapies for diabetes.”
EN CASTELLANO
El impulso de las células beta pancreáticas en ratones abre la puerta a futuros tratamientos para la diabetes
Un equipo de investigación ha impulsado con éxito la formación de las células beta pancreáticas en ratones. Los resultados han sido posibles gracias a la identificación de un gen que es fundamental para la regulación de la cantidad de células productoras de insulina durante el desarrollo embrionario del páncreas. Los hallazgos, publicados hoy en la revista Genes and Development, pueden impulsar futuros tratamientos de la enfermedad.
El equipo de investigación, del Centro de Regulación Genómica (CRG), el Instituto de Investigación Biomédica de Bellvitge (IDIBELL) y la Universidad de Barcelona, estudió el gen del factor de transcripción silenciador RE1, también conocido como REST por sus siglas en inglés, usando modelos de ratón y pez cebra. También estudiaron organoides pancreáticos humanos. El equipo sospechaba que REST tenía un papel decisivo en el desarrollo del páncreas, pero los estudios hasta la fecha no habían sido concluyentes.
El equipo descubrió que REST se expresa en las células pancreáticas embrionarias que aún no se han diferenciado, también conocidas como células progenitoras, así como en las células adultas que forman el conducto pancreático. Los investigadores no detectaron rastros de la actividad de REST en las células beta adultas que producen insulina.
Los experimentos con modelos de ratón revelaron que al eliminar el gen REST en la etapa embrionaria temprana, antes de que se forme el páncreas, se duplicaba el número de células productoras de insulina. Los ratones mantuvieron las células en su edad adulta y tuvieron un peso normal. Experimentos en paralelo con modelos de pez cebra mostraron resultados similares.
La inactivación de REST no impulsaba la formación de células beta después de la formación del páncreas. La inactivación de REST en ratones recién nacidos resultó en la formación de células endocrinas, pero estas no se mantuvieron hasta la edad adulta. La inactivación de REST en organoides pancreáticos humanos tampoco impulsó la formación de células beta, aunque los investigadores detectaron un incremento en la actividad de genes endocrinos.
“Aunque es importante para el desarrollo del páncreas, hemos demostrado que REST no es el único guardián de la diferenciación endocrina. Sin embargo, si algún día se nos ocurriera un futuro cóctel de medicamentos para estimular las células productoras de insulina en el páncreas, sospecho que los inhibidores de REST serían parte de la receta. Ahora estamos probando si los inhibidores de REST pueden usarse para estimular artificialmente la formación de células beta en células en cultivo,” afirma Jorge Ferrer, autor principal del estudio y jefe del grupo de Regulación Genómica y Diabetes en el CRG.
Las nuevas terapias y tratamientos que pueden aumentar o reemplazar la cantidad de células beta en el páncreas transformarían el tratamiento de la diabetes, que afecta a más de 400 millones de personas en todo el mundo. Por ejemplo, para las personas con diabetes tipo 1, el único tratamiento alternativo a las inyecciones diarias de insulina son los trasplantes, que tienen efectos secundarios, y requirien tomar medicamentos inmunosupresores. También hay escasez de donantes de órganos. Ser capaces de aumentar el número existente de células directamente en el páncreas evitaría muchos de estos retos.
“REST se suma a una lista muy corta de supresoras dominantes de la diferenciación endocrina durante el desarrollo del páncreas”, afirma Meritxell Rovira, coautora del estudio e investigadora con afiliación conjunta con el IDIBELL y la Universidad de Barcelona. "Los moduladores REST probablemente jugarán un papel importante para futuras manipulaciones para promover la endocrinogénesis en sistemas de modelos experimentales o terapias de reemplazo para la diabetes".
EN CATALÀ
L'impuls de les cèl·lules beta pancreàtiques en ratolins obre la porta a futurs tractaments per a la diabetis
Un equip d'investigació ha impulsat amb èxit la formació de cèl·lules beta pancreàtiques en ratolins. Els resultats han estat possibles gràcies a la identificació d'un gen que és fonamental per a la regulació del nombre de cèl·lules productores d'insulina durant el desenvolupament embrionari del pàncrees. Les troballes, publicades avui a la revista Genes and Development, poden impulsar futurs tractaments de la malaltia.
L'equip d'investigació, del Centre de Regulació Genòmica (CRG), l'Institut d'Investigació Biomèdica de Bellvitge (IDIBELL) i la Universitat de Barcelona, han estudiat el gen del factor de transcripció silenciador RE1, també conegut com REST per les sigles en anglès, usant models de ratolí i peix zebra. També han estudiat organoides pancreàtics humans. L'equip sospitava que REST tenia un paper decisiu en el desenvolupament del pàncrees, però els estudis fins ara no havien estat concloents.
L'equip ha descobert que REST s'expressa en les cèl·lules pancreàtiques embrionàries que encara no s'han diferenciat, també conegudes com a cèl·lules progenitores, així com en les cèl·lules adultes que formen el conducte pancreàtic. Els investigadors no han detectat rastres de l'activitat de REST en les cèl·lules beta adultes que produeixen insulina.
Els experiments amb models de ratolí han revelat que en eliminar el gen REST en l'etapa embrionària primerenca, abans que es formi el pàncrees, es duplica el nombre de cèl·lules productores d'insulina. Els ratolins mantenien les cèl·lules en la seva edat adulta i tenien un pes normal. Experiments en paral·lel amb models de peix zebra van obtenir resultats similars.
La inactivació de REST no impulsava la formació de cèl·lules beta després de la formació del pàncrees. La inactivació de REST en ratolins nounats resultava en la formació de cèl·lules endocrines, però aquestes no es mantenien fins a l'edat adulta. La inactivació de REST en organoides pancreàtics humans tampoc impulsava la formació de cèl·lules beta, encara que els investigadors van detectar un increment en l'activitat de gens endocrins.
"Encara que és important per al desenvolupament del pàncrees, hem demostrat que REST no és l'únic guardià de la diferenciació endocrina. No obstant això, si algun dia se'ns ocorregués un futur còctel de medicaments per estimular les cèl·lules productores d'insulina al pàncrees, sospito que els inhibidors de REST serien part de la recepta. Ara estem provant si els inhibidors de REST es poden utilitzar per estimular artificialment la formació de cèl·lules beta en cultiu", afirma Jorge Ferrer, autor principal de l'estudi i cap del grup de Regulació Genòmica i Diabetis al CRG.
Les noves teràpies i tractaments que poden augmentar o reemplaçar la quantitat de cèl·lules beta en el pàncrees transformarien el tractament de la diabetis, que afecta més de 400 milions de persones a tot el món. Per exemple, per a les persones amb diabetis tipus 1, l'únic tractament alternatiu a les injeccions diàries d'insulina són els trasplantaments, que tenen efectes secundaris, i requereixen prendre medicaments immunosupressors. També hi ha escassetat de donants d'òrgans. Ser capaços d'augmentar el nombre existent de cèl·lules directament en el pàncrees evitaria molts d'aquests reptes.
"REST se suma a una llista molt curta de supressores dominants de la diferenciació endocrina durant el desenvolupament del pàncrees", afirma Meritxell Rovira, coautora de l'estudi i investigadora amb afiliació conjunta amb l'IDIBELL i la Universitat de Barcelona. "Els moduladors REST probablement jugaran un paper important per a futures manipulacions per promoure l'endocrinogènesi en sistemes de models experimentals o teràpies de reemplaçament per a la diabetis".