NOTICIAS
NOTICIAS
‘Living medicine’ created to tackle drug-resistant lung infections
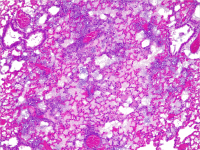
A cross-section of a mouse lung infected with Pseudonomas aeruginosa, resulting in severe pneumoniae. This is characterised by massive infiltration of inflammatory cells into the alveolar septa, resulting in loss of air in the alveoli. Credit: Rocco Mazzolini/CRG
Researchers have designed the first ‘living medicine’ to treat lung infections. The treatment targets Pseudomonas aeruginosa, a type of bacteria which is naturally resistant to many types of antibiotics and is a common source of infections in hospitals.
The treatment involves using a modified version of the bacterium Mycoplasma pneumoniae, removing its ability to cause disease and repurposing it to attack P. aeruginosa instead. The modified bacterium is used in combination with low doses of antibiotics that would otherwise not work on their own.
Researchers tested the efficacy of the treatment in mice, finding that it significantly reduced lung infections. The ‘living medicine’ doubled mouse survival rate compared to not using any treatment. Administering a single, high dose of the treatment showed no signs of toxicity in the lungs. Once the treatment had finished its course, the innate immune system cleared the modified bacteria in a period of four days.
The findings are published in the journal Nature Biotechnology and are supported by the “la Caixa” Foundation through the CaixaResearch Health call. The study was led by researchers at the Centre for Genomic Regulation (CRG) and Pulmobiotics in collaboration with the Institut d'Investigacions Biomèdiques August Pi i Sunyer (IDIBAPS), Hospital Clinic de Barcelona and the Institute of Agrobiotechnology (IdAB), a joint research institute of Spain’s CSIC and the government of Navarre.
P. aeruginosa infections are difficult to treat because the bacteria lives in communities that form biofilms. Biofilms can attach themselves to various surfaces in the body, forming impenetrable structures that escape the reach of antibiotics.
P. aeruginosa biofilms can grow on the surface of endotracheal tubes used by critically-ill patients who require mechanical ventilators to breathe. This causes ventilator-associated pneumonia (VAP), a condition which affects one in four (9-27%) patients who require intubation. The incidence exceeds 50% for patients intubated because of severe Covid-19. VAP can extend the duration in intensive care unit for up to thirteen days and kills up to one in eight patients (9-13%).
The authors of the study engineered M. pneumoniae to dissolve biofilms by equipping it with the ability to produce various molecules including pyocins, toxins naturally produced by bacteria to kill or inhibit the growth Pseudomonas bacterial strains. To test its efficacy, they collected P. aeruginosa biofilms from the endotracheal tubes of patients in intensive care units. They found the treatment penetrated the barrier and successfully dissolved the biofilms.
“We have developed a battering ram that lays siege to antibiotic-resistant bacteria. The treatment punches holes in their cell walls, providing crucial entry points for antibiotics to invade and clear infections at their source. We believe this is a promising new strategy to address the leading cause of mortality in hospitals,” says Dr. María Lluch, Chief Scientific Officer at Pulmobiotics, co-corresponding author of the study and principal investigator at the International University of Catalonia.
With the aim of using the ‘living medicine’ to treat VAP, the researchers will carry out further tests before reaching the clinical trial phase. The treatment is expected to be administered using a nebulizer, a device that turns liquid medicine into a mist which is then inhaled through a mouthpiece or a mask.
M. pneumoniae is one of the smallest known species of bacteria. Dr. Luis Serrano, Director of the CRG, first had the idea to modify the bacteria and use it as a ‘living medicine’ two decades ago. Dr. Serrano is a specialist in synthetic biology, a field that involves repurposing organisms and engineering them to have new, useful abilities. With just 684 genes and no cell wall, the relative simplicity of M. pneumoniae makes it ideal for engineering biology for specific applications.
One of the advantages of using M. pneumoniae to treat respiratory diseases is that it is naturally adapted to lung tissue. After administering the modified bacterium, it travels straight to the source of a respiratory infection, where it sets up shop like a temporary factory and produces a variety of therapeutic molecules.
By showing that M. pneumoniae can tackle infections in the lung, the study opens the door for researchers creating new strains of the bacteria to tackle other types of respiratory diseases such as lung cancer or asthma. “The bacterium can be modified with a variety of different payloads – whether these are cytokines, nanobodies or defensins. The aim is to diversify the modified bacterium’s arsenal and unlock its full potential in treating a variety of complex diseases,” says ICREA Research Professor Dr. Luis Serrano.
In addition to designing the ‘living medicine’, Dr. Serrano’s research team are also using their expertise in synthetic biology to design new proteins that can be delivered by M. pneumoniae. The team are using these proteins to target inflammation caused by P. aeruginosa infections.
Though inflammation is the body's natural response to an infection, excessive or prolonged inflammation can damage lung tissue. The inflammatory response is orchestrated by the immune system, which release mediator proteins such as cytokines. One type of cytokine – IL-10 – has well-known anti-inflammatory properties and is of growing therapeutic interest.
Research published in the journal Molecular Systems Biology by Dr. Serrano’s research group used protein-design softwares ModelX and FoldX to engineer new versions of IL-10 purposefully optimised to treat inflammation. The cytokines were designed to be created more efficiently and to have higher affinity, meaning less cytokines are needed to have the same effect.
The researchers engineered strains of M. pneumoniae that expressed the new cytokines and tested its efficacy in the lungs of mice with acute P. aeruginosa infections. They found that engineered versions of IL-10 were significantly more effective at reducing inflammation compared to the wild type IL-10 cytokine.
According to Dr. Ariadna Montero Blay, co-corresponding author of the study in Molecular Systems Biology, “live biotherapeutics such as M. pneumoniae provide ideal vehicles to help overcome the traditional limitations of cytokines and unlock their huge potential in treating a variety of human diseases. Engineering cytokines as therapeutic molecules was critical to tackle inflammation. Other lung diseases such as asthma or pulmonary fibrosis could also stand to benefit from this approach.”
EN CASTELLANO
Crean una 'píldora viva' para combatir las infecciones pulmonares resistentes a los antibióticos
Un equipo de investigación ha diseñado la primera "píldora viva" para tratar las infecciones pulmonares. El tratamiento se dirige a Pseudomonas aeruginosa, un tipo de bacteria que es naturalmente resistente a muchos tipos de antibióticos y es una fuente común de infecciones en los hospitales.
El tratamiento consiste en utilizar una versión modificada de la bacteria Mycoplasma pneumoniae, eliminando su capacidad patógena y adaptarla para que, en su lugar, ataque a P. aeruginosa. La bacteria modificada se usa en combinación con dosis bajas de antibióticos que no serían eficaces por sí solas.
El equipo científico observó que el uso del tratamiento en ratones redujo significativamente las infecciones pulmonares. La "píldora viva" duplicó la tasa de supervivencia del ratón en comparación con la opción de no usar ningún tratamiento. La administración de una única dosis alta del tratamiento no mostró signos de toxicidad en los pulmones. Una vez que el tratamiento hubo terminado su curso, el sistema inmune innato eliminó las bacterias modificadas en un período de cuatro días.
Los hallazgos se publican en la revista Nature Biotechnology y cuentan con el apoyo de la Fundación "la Caixa" a través de la convocatoria CaixaResearch Health. El estudio ha sido liderado por el Centro de Regulación Genómica (CRG) y Pulmobiotics en colaboración con el Institut d'Investigacions Biomèdiques August Pi i Sunyer (IDIBAPS), el Hospital Clínic de Barcelona y el Instituto de Agrobiotecnología (IdAB), un instituto de investigación del CSIC y el gobierno de Navarra.
Las infecciones causadas por P. aeruginosa son difíciles de tratar porque la bacteria vive en comunidades que forman biopelículas. Las biopelículas pueden adherirse a varias superficies del cuerpo, formando estructuras impenetrables que escapan al alcance de los antibióticos.
Las biopelículas de P. aeruginosa crecen en la superficie de los tubos endotraqueales utilizados por pacientes en estado crítico quienes, por lo tanto, requieren ventiladores mecánicos para respirar. Esto causa neumonía asociada al ventilador (NAV), una afección que afecta hasta uno de cada cuatro (9-27 %) pacientes que requieren intubación. La incidencia supera el 50 % en el caso de los pacientes intubados por covid-19 grave. La NAV puede prolongar la estancia en la unidad de cuidados intensivos hasta un periodo de trece días, y tiene una tasa de mortalidad que alcanza a uno de cada ocho pacientes (9-13 %).
M. pneumoniae fue diseñado para disolver biopelículas. El equipo científico modificó la bacteria para proporcionarle la capacidad de producir varias moléculas, incluidas las piocinas, toxinas producidas naturalmente por las bacterias para matar o inhibir el crecimiento de varias cepas de Pseudomonas. Para probar su eficacia, recogieron biopelículas de P. aeruginosa de los tubos endotraqueales de pacientes en unidades de cuidados intensivos. Mostraron que el tratamiento atraviesa la barrera y disuelve con éxito las biopelículas.
«Hemos desarrollado un ariete que asedia a las bacterias resistentes a los antibióticos. El tratamiento abre orificios en las paredes celulares y crea unos puntos de entrada fundamentales para que los antibióticos las invadan y eliminen la infección en su origen. Creemos que es una nueva estrategia prometedora para abordar la principal causa de mortalidad hospitalaria», dice la Dra. María Lluch, directora científica de Pulmobiotics, coautora principal del estudio e investigadora de la Universidad Internacional de Cataluña.
Con el objetivo de utilizar la "píldora viva" para tratar la NAV, se llevarán a cabo más pruebas antes de llegar a la fase de ensayo clínico. Se prevé administrar el tratamiento con un nebulizador, un dispositivo que transforma el medicamento líquido en una niebla que se inhala a través de una boquilla o de una máscara.
M. pneumoniae es una de las especies de bacterias más pequeñas conocidas. El Dr. Luis Serrano, director del CRG, tuvo la idea de modificar la bacteria y usarla como una "píldora viva" hace dos décadas. El Dr. Serrano es especialista en biología sintética, un campo que implica la ingeniería de organismos para que tengan habilidades nuevas y útiles. Con solo 684 genes y sin pared celular, la relativa simplicidad de M. pneumoniae la hace ideal para la ingeniería biológica para aplicaciones específicas.
Una de las ventajas de usar M. pneumoniae para tratar enfermedades respiratorias es que está adaptada naturalmente al tejido pulmonar. Después de administrar la bacteria modificada, viaja directamente al origen de una infección respiratoria, donde se establece como una fábrica temporal y produce una variedad de moléculas terapéuticas.
Al demostrar que M. pneumoniae puede abordar las infecciones en el pulmón, el estudio abre la puerta al desarrollo de nuevas cepas de la bacteria para abordar otros tipos de enfermedades respiratorias como el cáncer de pulmón o el asma. «La bacteria se puede modificar con una variedad de cargas activas distintas, ya sean citoquinas, nanoanticuerpos o defensinas. El objetivo es diversificar el arsenal de la bacteria modificada y liberar su potencial en el tratamiento de una variedad de enfermedades complejas», afirma el Profesor de Investigación ICREA Dr. Luis Serrano.
Además de diseñar la "píldora viva", el laboratorio del Dr. Serrano también está utilizando su experiencia en biología sintética para diseñar nuevas proteínas que pueden ser administradas por M. pneumoniae. El equipo está utilizando estas proteínas para atacar la inflamación causada por las infecciones por P. aeruginosa.
Aunque la inflamación es una respuesta natural del cuerpo en reacción a una infección, la inflamación excesiva o prolongada puede dañar el tejido pulmonar. La respuesta inflamatoria es orquestada por el sistema inmune, que libera proteínas mediadoras como las citoquinas. Un tipo de citoquina, IL-10, tiene propiedades antiinflamatorias bien conocidas, lo que, por tanto, hace que sea de creciente interés terapéutico.
Una investigación publicada en la revista Molecular Systems Biology por el grupo de investigación del Dr. Serrano utilizó ModelX y FoldX, dos programas informáticos para el diseño de proteínas, para crear nuevas versiones de IL-10 optimizadas para el tratamiento de la inflamación. Estas nuevas citoquinas tienen nuevas propiedades que mejoran su eficiencia y afinidad.
El equipo científico diseñó cepas de M. pneumoniae que expresan estas nuevas citoquinas y probaron su eficacia en los pulmones de ratones con infecciones agudas por P. aeruginosa. Mostraron que las versiones diseñadas de IL-10 eran significativamente más efectivas para reducir la inflamación en comparación con la citoquina IL-10 natural.
Ariadna Montero Blay, coautora principal del estudio en Molecular Systems Biology, indica que «las soluciones bioterapéuticas como M. pneumoniae proporcionan vehículos ideales para superar las limitaciones tradicionales de las citoquinas y desbloquear su enorme potencial en el tratamiento de una variedad de enfermedades humanas. La ingeniería de citoquinas como moléculas terapéuticas fue fundamental para combatir la inflamación. Otras enfermedades pulmonares como el asma o la fibrosis pulmonar también podrían beneficiarse de este enfoque».
EN CATALÀ
Creen una ‘píndola viva’ per a combatre les infeccions pulmonars resistents als antibiòtics
Un equip de recerca ha dissenyat la primera ‘píndola viva’ per a tractar les infeccions pulmonars. El tractament es dirigeix a Pseudomonas aeruginosa, un tipus de bacteri que és naturalment resistent a molts tipus d’antibiòtics i és una font comuna d’infeccions als hospitals.
El tractament consisteix a utilitzar una versió modificada del bacteri Mycoplasma pneumoniae, eliminant la seva capacitat patògena i adaptar-la per a què ataqui a P. aeruginosa. El bacteri modificat s’empra en combinació amb dosis baixes d’antibiòtics que no serien eficaços per si soles.
L’equip científic observà que l’ús del tractament en ratolins reduí significativament les infeccions pulmonars. La ‘píndola viva’ duplicà la taxa de supervivència del ratolí en comparació amb l’opció de no emprar cap tractament. L’administració d’una única dosi alta del tractament no mostrà signes de toxicitat als pulmons. Un cop el tractament va acabar el seu curs, el sistema immune innat eliminà els bacteris modificats en un període de quatre dies.
Les troballes es publiquen a la revista Nature Biotechnology i compten amb el suport de la Fundación ‘la Caixa’ a través de la convocatòria CaixaResearch Health. L’estudi ha estat liderat pel Centre de Regulació Genòmica (CRG) i Pulmobiotics en col·laboració amb l’Institut d’Investigacions Biomèdiques August Pi i Sunyer (IDIBAPS), l’Hospital Clínic de Barcelona i l’Instituto de Agrobiotecnología (IdAB), un institut de recerca del CSIC i el govern de Navarra.
Les infeccions causades per P. aeruginosa són difícils de tractar perquè el bacteri viu en comunitats que formen biopel·lícules. Les biopel·lícules poden adherir-se a vàries superfícies del cos, formant estructures impenetrables que escapen a l’abast dels antibiòtics.
Les biopel·lícules de P. aeruginosa creixen a la superfície dels tubs endotraqueals utilitzats per pacients en estat crític els quals, per tant, requereixen ventiladors mecànics per respirar. Això causa pneumònia associada al ventilador (NAV), una afecció que afecta fins a un de cada quatre (9-27%) pacients que requereixen intubació. La incidència supera el 50% en el cas dels pacients intubats per covid-19 greu. La NAV pot prolongar l’estada a la unitat de cures intensives fins a un període de tretze dies, i té una taxa de mortalitat que assoleix el 9-13% (un de cada vuit pacients).
M. pneumoniae es dissenyà per a dissoldre biopel·lícules. L’equip científic modificà el bacteri per proporcionar-li la capacitat de produir diverses molècules, incloses les piocines, toxines produïdes naturalment pels bacteris per matar o inhibir el creixement de diverses soques de Pseudomonas. Per provar la seva eficàcia, recolliren biopel·lícules de P. aeruginosa dels tubs endotraqueals de pacients en unitats de cures intensives. Mostraren que el tractament travessa la barrera i dissol amb èxit les biopel·lícules.
«Hem desenvolupat un ariet que assetja els bacteris resistents als antibiòtics. El tractament obre orificis a les parets cel·lulars i crea uns punts d’entrada fonamentals per a què els antibiòtics les envaeixin i eliminin la infecció a l’origen. Creiem que és una nova estratègia prometedora per abordar la principal causa de mortalitat hospitalària», diu la Dra. Maria Lluch, directora científica de Pulmobiotics, coautora principal de l’estudi i investigadora de la Universitat Internacional de Catalunya.
Amb l’objectiu d’utilitzar la ‘píndola viva’ per a tractar la NAV, es duran a terme més proves abans d’arribar a la fase d’assajos clínics. Es preveu administrar el tractament amb un nebulitzador, un dispositiu que transforma el medicament líquid en una boira que s’inhala a través d’un broquet o d’una màscara.
M. pneumoniae és una de les espècies de bacteris més petites conegudes. El Dr. Luis Serrano, director del CRG, va tenir la idea de modificar el bacteri i emprar-lo com a una ‘píndola viva’ fa dues dècades. El Dr. Serrano és especialista en biologia sintètica, un camp que implica l’enginyeria d’organismes pera què tinguin habilitats noves i útils. Amb només 684 gens i sense paret cel·lular, la relativa simplicitat de M. pneumoniae la fa ideal per a l’enginyeria biològica per aplicacions específiques.
Un dels avantatges d’emprar M. pneumoniae per a tractar malalties respiratòries és que està adaptada naturalment al teixit pulmonar. Després d’administrar el bacteri modificat, viatja directament a l’origen d’una infecció respiratòria, on s’estableix com a una fàbrica temporal i produeix una varietat de molècules terapèutiques.
En demostrar que M. pneumoniae pot abordar les infeccions al pulmó, l’estudi obre la porta al desenvolupament de noves soques del bacteri per abordar altres tipus de malalties respiratòries com el càncer de pulmó i l’asma. «El bacteri es pot modificar amb una varietat de càrregues actives distintes, ja siguin citocines, nanoanticossos o defensines. L’objectiu és diversificar l’arsenal del bacteri modificat i alliberar el seu potencial en el tractament d’una varietat de malalties complexes» , afirma el Professor d’Investigació ICREA Dr. Luis Serrano.
A més de dissenyar la ‘píndola viva’, el laboratori del Dr. Serrano també està emprant la seva experiència en biologia sintètica per dissenyar noves proteïnes que puguin ésser administrades per M. pneumoniae. L’equip està utilitzant aquestes proteïnes per atacar la inflamació causada per les infeccions per P. aeruginosa.
Tot i que la inflamació és una resposta natural del cos en reacció a una infecció, la inflamació excessiva o prolongada pot malmetre el teixit pulmonar. La resposta inflamatòria està orquestrada pel sistema immune, que allibera proteïnes mediadores com les citocines. Un tipus de citocina, l’IL-10, té propietats antiinflamatòries ben conegudes, fet que, per tant, fa que sigui de creixent interès terapèutic.
Una recerca publicada a la revista Molecular Systems Biology pel grup de recerca del Dr. Serrano utilitzà ModelX i FoldX, dos programes informàtics per al disseny de proteïnes, per a crear noves versions d’IL-10 optimitzades per al tractament de la inflamació. Aquestes noves citocines tenen noves propietats que milloren la seva eficiència i afinitat.
L’equip científic dissenyà soques d’ M. pneumoniae que expressen aquestes noves citocines i provaren la seva eficàcia en els pulmons de ratolins amb infeccions agudes per P. aeruginosa. Mostraren que les versions dissenyades d’IL-10 eren significativament més efectives per a reduir la inflamació en comparació amb la citocina IL-10 natural.
Ariadna Montero Blay, coautora principal de l’estudi a Molecular Systems Biology, indica que «les solucions bioterapèutiques com M. pneumoniae proporcionen vehicles ideals per superar les limitacions tradicionals de les citocines i desbloquejar el seu enorme potencial en el tractament d’una varietat de malalties humanes. L’enginyeria de citocines com a molècules terapèutiques fou fonamental per a combatre la inflamació. D’altres malalties pulmonars com l’asma o la fibrosi pulmonar també podrien beneficiar-se d’aquest enfocament».