NEWS
NEWS
Researchers reveal how cells rewrite their fate
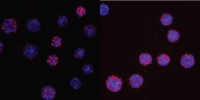
C/EBPαR35A interacts more strongly with PU.1 than unmated C/EBPα, shown here by an assay that scores the proximity of antibodies against the two proteins. Credit: Thomas Graf/Centre for Genomic Regulation
Researchers at the Centre for Genomic Regulation (CRG) in Barcelona and the Max Delbrück Center for Molecular Medicine in the Helmholtz Association in Berlin reveal how cells accelerate changes to their identity, a process known as cell fate conversion.
The study, published today in the journal eLife, has implications for cancer research as the disease often arises from errors in cell fate decisions. The study could eventually lead to new methods of accelerating or manipulating the molecular mechanisms involved in the formation of cancer.
Central to the study is C/EBPα (CCAAT/enhancer-binding protein alpha), a protein that orchestrates the conversion of B lymphocytes to macrophages, another type of immune cell. C/EBPα is a transcription factor, a type of protein which binds to specific DNA sequences in the regulatory regions of genes to influence the rate of transcription, the first step that leads to the activation or silencing of protein expression. Transcription factors play a vital role in the transformation of one cell type to another during differentiation and development, as well as in the growth and function of cells.
Like many other proteins, C/EBPα is modified by enzymes, for example through the addition of a methyl group to specific amino acids. These modifications can have significant effects on interactions of the protein. The researchers found that when one specific arginine residue of C/EBPα is left unmethylated, it greatly accelerates the conversion process of B lymphocytes to macrophages.
The study also found that the methylation of this specific arginine residue is mediated by the enzyme Carm1. Previous research has shown that Carm1-deficient mice are resistant to induced forms of acute myeloid leukaemia. The researchers hypothesise that the mechanisms they uncover in the present study can explain why: the unmethylated version of C/EBPα is a stronger inducer of macrophage differentiation compared to its methylated counterpart. As macrophages are a non-dividing cell type, this could prevent the formation of cancer cells.
Dr. Thomas Graf, senior author from the Centre for Genomic Regulation, says: “By understanding how cell fate conversion can be accelerated or directed, we uncover new clues for cancer research. For example, targeting the balance between methylated and unmethylated forms of C/EBPα can help us understand how immune cells differentiate and eventually lead to new ideas for treating certain forms of leukaemia.”
The researchers made the discovery while screening for C/EBPα mutants which affect the efficiency of cell fate conversion using human and mouse models. The location of the critical amino acid within C/EBPα was found when the authors tested a mutant form called C/EBPαR35A. This mutant dramatically accelerated the speed by which B cells could be turned into macrophages.
To induce a cell conversion, C/EBPα works by interacting with another transcription factor called PU.1, which itself is essential for the development of immune cells and is already expressed in B cells. C/EBPαR35A had a much higher interaction affinity with PU.1, increasing the speed by which the combination of the two proteins silence the genes associated with B cells and activate the genes associated with macrophages.
The methylation of C/EBPα is an example of an epigenetic mechanism. These are mechanisms which modify how the genome – the instruction manual inside every cell of the human body – is read. “Drugs that affect epigenetic mechanisms as described in the present study may indeed alter the function of transcription factors and correct cells that went astray, such as seen in cancer and leukaemia,” says Dr. Achim Leutz, senior author from the Max-Delbrück-Center.
“In this novel mechanism PU.1 is triggered by C/EBPα to switch from a B cell regulator into a macrophage regulator, an elegant ‘on-off’ mechanism that ensures the faithful formation of a mature cell type, avoiding the formation of ‘confused‘ cells often seen in blood cancers. Therefore, drugs might be found that target this mechanism to correct such defects” adds Dr. Leutz.
According to the authors of the study, much remains unknown about what determines the speed and directionality of cell fate decisions and their new work suggests that the two processes are two sides of the same coin. For instance, how do stem cells sequentially transform into the many different types of cells in the body? Better understanding how cells change their identity and how to manipulate the process might have applications from regenerative medicine to improving the efficacy of drugs against cancer.
The research was led by a joint collaboration between the Centre for Genomic Regulation in Barcelona, the Max Delbrück Center for Molecular Medicine in Berlin and the University of Pennsylvania in Philadelphia. The study was funded by the Spanish Ministry of Economy, Industry and Competitiveness, the Catalan Agency of Research and Universities, a 4D-Genome European Research Council Synergy grant, by funds from the Max-Delbrueck-Center, and the United States National Institute of Health.
EN CASTELLANO
Un mecanismo molecular revela cómo las células controlan su destino
Un equipo científico del Centro de Regulación Genómica (CRG), en Barcelona, y del Centro Max Delbrück de Medicina Molecular de la Asociación Helmholtz, en Berlín, revelan cómo las células aceleran cambios en su identidad, un proceso conocido como conversión del destino celular.
El estudio, publicado hoy en la revista eLife, tiene implicaciones para la investigación del cáncer, ya que la enfermedad a menudo surge a causa de errores en las decisiones sobre el destino celular. El estudio podría eventualmente conducir a nuevos métodos para acelerar o manipular los mecanismos moleculares involucrados en la formación del cáncer.
El protagonista central del estudio es C/EBPα (CCAAT/enhancer-binding protein alpha), una proteína que orquesta la conversión de linfocitos B, un tipo de célula inmune, en macrófagos, otro tipo de célula inmunitaria. C/EBPα es un factor de transcripción, un tipo de proteína que se une a las secuencias de ADN en las regiones reguladoras de los genes para influir en la tasa de transcripción, el primer paso que conduce a la activación o al silenciamiento de la expresión génica. Los factores de transcripción juegan un papel vital en la transformación de un tipo celular a otro durante la diferenciación y el desarrollo, así como en el crecimiento y función de las células.
A C/EBPα la modifican enzimas como, por ejemplo, mediante la adición de un grupo metilo a uno de sus aminoácidos constituyentes. Estas modificaciones pueden tener efectos importantes en las interacciones de la proteína. Los autores del estudio encontraron que cuando un residuo de arginina específico de C/EBPα se deja sin metilar, esto acelera en gran medida el proceso de conversión de linfocitos B en macrófagos.
Según el estudio, la metilación de este residuo específico de arginina está mediada por la enzima Carm1. Estudios anteriores han demostrado que los ratones deficientes en Carm1 son resistentes a la inducción de la leucemia mieloide aguda. Los mecanismos que han descubierto en el presente estudio pueden explicar por qué: la versión no metilada de C/EBPα induce la diferenciación de macrófagos con más fuerza, en comparación con su contraparte metilada. Como los macrófagos son un tipo de célula que no se divide, esto podría prevenir la formación de células cancerosas.
El Dr. Thomas Graf, coautor principal del estudio e investigador del Centro de Regulación Genómica, afirma: “Al comprender cómo se puede acelerar o dirigir la conversión del destino celular, descubrimos nuevas pistas para la investigación del cáncer. Por ejemplo, centrarse en el equilibrio entre las formas metiladas y no metiladas de C/EBPα puede ayudarnos a comprender cómo se diferencian las células inmunes y, finalmente, conducirnos a nuevas ideas para tratar ciertas formas de leucemia”.
El equipo científico hizo el descubrimiento mientras buscaban mutantes de C/EBPα que afectan a la eficiencia de la conversión del destino celular utilizando modelos humanos y de ratón. La ubicación del aminoácido crítico dentro de C/EBPα se encontró cuando los autores probaron una forma mutante llamada C/EBPαR35A. Este mutante aceleró drásticamente la velocidad a la que las células B podían convertirse en macrófagos.
Para inducir una conversión celular, C/EBPα interactúa con otro factor de transcripción llamado PU.1, que en sí mismo es esencial para el desarrollo de las células inmunes y ya se expresa en las células B. C/EBPαR35A tenía una afinidad de interacción mucho mayor con PU.1, lo que aumentaba la velocidad con la que la combinación de las dos proteínas silenciaba los genes asociados con las células B y activaba los genes asociados con los macrófagos.
La metilación de C/EBPα es un ejemplo de un mecanismo epigenético. Son mecanismos que modifican la forma de leer el genoma, el manual de instrucciones dentro de cada célula del cuerpo humano. "Los fármacos que actúan sobre los mecanismos epigenéticos, como se describe en el presente estudio, pueden alterar la función de los factores de transcripción y corregir las células que se desviaron, como se ve en el cáncer y la leucemia", dice el Dr. Achim Leutz, coautor principal del estudio e investigador del Centro Max Delbrück.
“En este mecanismo nuevo, PU.1 es activado por C/EBPα para que pase de ser un regulador de células B a un regulador de macrófagos, un elegante mecanismo de 'encendido y apagado' que asegura la formación fiel de un tipo de célula madura, evitando la formación de células confusas que a menudo se observan en los cánceres de la sangre. Esto allana el camino para encontrar fármacos que se dirijan a este mecanismo y corregir dichos defectos”, añade el Dr. Leutz.
Según los autores del estudio, queda mucho por saber sobre lo que determina la velocidad y la direccionalidad de las decisiones sobre el destino de las células. El trabajo sugiere que los dos procesos son las dos caras de la misma moneda. Por ejemplo, ¿cómo se transforman secuencialmente las células madre en los diferentes tipos de células del cuerpo? Comprender mejor cómo las células cambian su identidad y cómo manipular el proceso podría tener aplicaciones desde la medicina regenerativa hasta la mejora de la eficacia de los medicamentos contra el cáncer.
La investigación fue dirigida por una colaboración conjunta entre el Centro de Regulación Genómica, en Barcelona, el Centro Max Delbrück de Medicina Molecular, en Berlín, y la Universidad de Pensilvania, en Filadelfia. El estudio ha sido financiado por el Ministerio de Economía, Industria y Competitividad español, la Agencia de Gestión de Ayudas Universitarias y de Investigación en Catalunya, el Consejo Europeo de Investigación, fondos del Centro Max Delbrück y el Instituto Nacional de Salud (NIH) de los Estados Unidos.
EN CATALÀ
Un mecanisme molecular revela com les cèl·lules controlen el seu destí
Un equip científic del Centre de Regulació Genòmica (CRG), a Barcelona, i del Centre Max Delbrück de Medicina Molecular de l'Associació Helmholtz, a Berlín, revelen com les cèl·lules acceleren canvis en la seva identitat, un procés conegut com a conversió del destí cel·lular.
L'estudi, publicat avui a la revista eLife, té implicacions per a la investigació del càncer, ja que la malaltia sovint sorgeix a causa d'errors en les decisions sobre el destí cel·lular. L'estudi podria eventualment conduir a nous mètodes per accelerar o manipular els mecanismes moleculars involucrats en la formació del càncer.
El protagonista central de l'estudi és C/EBPα (CCAAT/enhancer-binding protein alpha), una proteïna que orquestra la conversió de limfòcits B, un tipus de cèl·lula immune, en macròfags, un altre tipus de cèl·lula immune. C/EBPα és un factor de transcripció, un tipus de proteïna que s'uneix a les seqüències d'ADN a les regions reguladores dels gens per influir en la taxa de transcripció, el primer pas que condueix a l'activació o al silenciament de l'expressió gènica. Els factors de transcripció juguen un paper vital en la transformació d'un tipus cel·lular a un altre durant la diferenciació i el desenvolupament, així com en el creixement i funció de les cèl·lules.
A C/EBPα la modifiquen enzims, per exemple, mitjançant l'addició d'un grup metil a un dels seus aminoàcids constituents. Aquestes modificacions poden tenir efectes importants en les interaccions de la proteïna. Els autors de l'estudi van trobar que quan un residu d'arginina específic de C/EBPα es deixa sense metilar, això accelera en gran mesura el procés de conversió de limfòcits B en macròfags.
Segons l'estudi, la metilació d'aquest residu específic d'arginina està facilitada per l'enzim Carm1. Estudis anteriors han demostrat que els ratolins deficients a Carm1 són resistents a la inducció de la leucèmia mieloide aguda. Els mecanismes que han descobert en el present estudi poden explicar per què: la versió no metilada de C/EBPα indueix la diferenciació de macròfags amb més força, en comparació amb la seva contrapart metilada. Com que els macròfags són un tipus de cèl·lula que no es divideix, això podria prevenir la formació de cèl·lules canceroses.
El Dr. Thomas Graf, coautor principal de l'estudi i investigador del Centre de Regulació Genòmica, afirma: "En comprendre com es pot accelerar o dirigir la conversió del destí cel·lular, descobrim noves pistes per a la investigació del càncer. Per exemple, centrar-se en l'equilibri entre les formes metilades i no metilades de C/EBPα pot ajudar-nos a comprendre com es diferencien les cèl·lules immunes i, finalment, conduir-nos a noves idees per tractar certes formes de leucèmia".
L'equip científic va fer el descobriment mentre buscaven mutants de C/EBPα que afecten l'eficiència de la conversió del destí cel·lular utilitzant models humans i de ratolí. La ubicació de l'aminoàcid crític dins de C/EBPα es va trobar quan els autors van provar una forma mutant anomenada C/EBPαR35A. Aquest mutant va accelerar dràsticament la velocitat a la qual les cèl·lules B podien convertir-se en macròfags.
Per induir una conversió cel·lular, C/EBPα interactua amb un altre factor de transcripció anomenat PU.1, que en si mateix és essencial per al desenvolupament de les cèl·lules immunes i ja s'expressa en les cèl·lules B. C/EBPαR35A tenia una afinitat d'interacció molt més gran amb PU.1, cosa que augmentava la velocitat amb què la combinació de les dues proteïnes silenciava els gens associats amb les cèl·lules B i activava els gens associats amb els macròfags.
La metilació de C/EBPα és un exemple d'un mecanisme epigenètic. Són mecanismes que modifiquen la forma de llegir el genoma, el manual d'instruccions dins de cada cèl·lula del cos humà. "Els fàrmacs que actuen sobre els mecanismes epigenètics, com es descriu en el present estudi, poden alterar la funció dels factors de transcripció i corregir les cèl·lules que es van desviar, com es veu en el càncer i la leucèmia", diu el Dr. Achim Leutz, coautor principal de l'estudi i investigador del Centre Max Delbrück.
"En aquest mecanisme nou, PU.1 és activat per C/EBPα perquè passi de ser un regulador de cèl·lules B a ser un regulador de macròfags, un elegant mecanisme d'encesa i apagat que assegura la formació fidel d'un tipus de cèl·lula madura, evitant la formació de cèl·lules confuses que sovint s'observen en els càncers de la sang. Això aplana el camí per trobar fàrmacs que es dirigeixin a aquest mecanisme i corregir aquests defectes", afegeix el Dr. Leutz.
Segons els autors de l'estudi, queda molt per saber sobre el que determina la velocitat i la direccionalitat de les decisions sobre el destí de les cèl·lules. El treball suggereix que els dos processos són les dues cares de la mateixa moneda. Per exemple, com es transformen seqüencialment les cèl·lules mare en els diferents tipus de cèl·lules del cos? Comprendre millor com les cèl·lules canvien la seva identitat i com manipular el procés podria tenir aplicacions des de la medicina regenerativa fins a la millora de l'eficàcia dels medicaments contra el càncer.
La investigació va ser dirigida per una col·laboració conjunta entre el Centre de Regulació Genòmica, a Barcelona, el Centre Max Delbrück de Medicina Molecular, a Berlín, i la Universitat de Pennsilvània, a Filadèlfia. L'estudi ha estat finançat pel Ministeri d'Economia, Indústria i Competitivitat espanyol, l'Agència de Gestió d'Ajuts Universitaris i de Recerca a Catalunya, el Consell Europeu de Recerca, fons del Centre Max Delbrück i l'Institut Nacional de Salut (NIH) dels Estats Units.